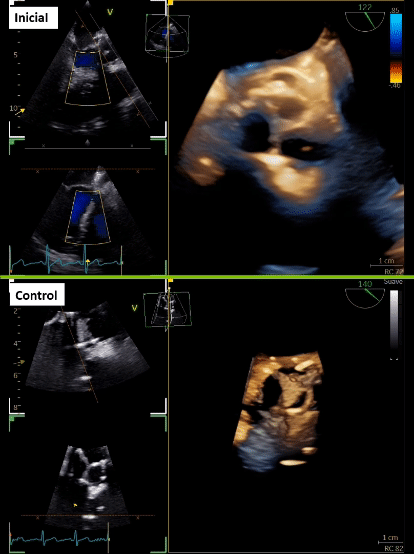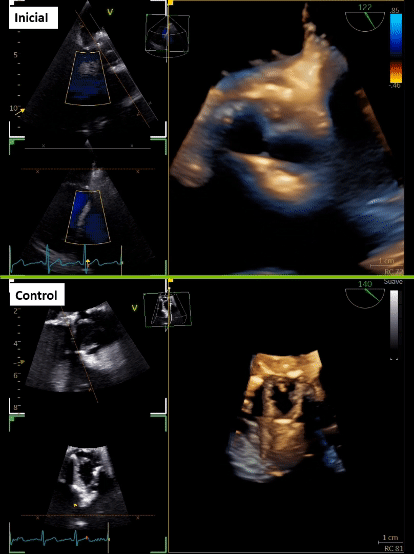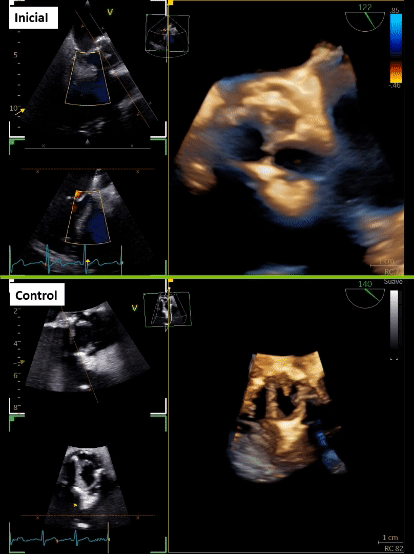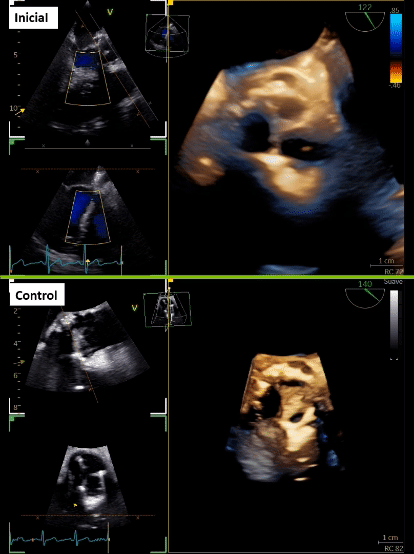
Hombre 59 años con antecedente de reemplazo valvular aórtico biológico y puente aorto-coronario hace 3 meses, que consulta por fiebre y dolor abdominal. Estudio con ecocardiograma con evidencia de endocarditis sobre válvula protésica, pero no categórico de compromiso a nivel de la fibrosa mitro-aórtica, por lo que se complementa con TAC cardiaco (TCC) y tomografía con emisión de positrones (PET)/CT.


Descripción


Hombre de 59 años con antecedentes de hipertensión arterial, diabetes mellitus, cardiópata coronario con antecedente de angioplastia con stent a arteria coronaria derecha en 2015. Además, sometido recientemente en contexto de estenosis aórtica sintomática y enfermedad severa de primera marginal, a reemplazo valvular aórtico con prótesis biológica y monobypass a OM1.
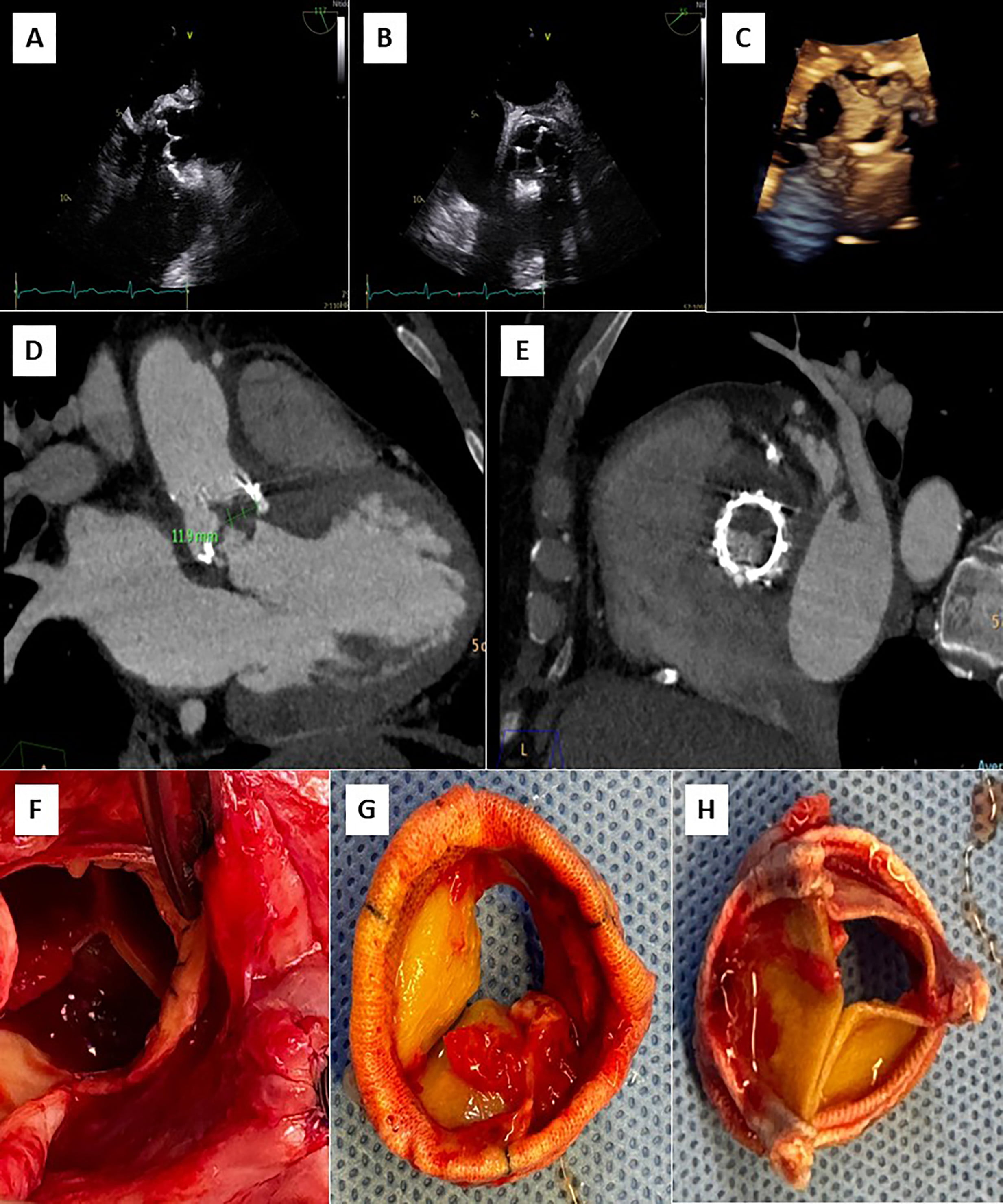
Tras 3 meses de cirugía cardiaca, consulta en urgencia por historia de 2 semanas de evolución caracterizada por dolor abdominal en flanco derecho que se irradia a región lumbar, acompañado de escalofríos de predominio vespertinos, y en exámenes destacan parámetros inflamatorios elevados. Inicialmente se realizó estudio imagenológico abdominal que sugirió pielonefritis aguda derecha, no obstante, destacó orina completa normal y urocultivo negativo. Se trasladó a medicina interna, donde se realizan hemocultivos que resultaron positivos a Stafilococcus warneri. Dado microorganismo, se realiza estudio con sospecha de endocarditis, con un primer estudio ecocardiográfico transtorácico y transesofágico que fue informado como negativo para endocarditis. Tras 7 días aproximadamente, con una alta sospecha, se complementan hallazgos con nuevo ecocardiograma transesofágico que describe velo protésico izquierdo tapizado de vegetaciones (Figura 1A, 1B y 1C; Video 1), pero dada cirugía cardiaca reciente los hallazgos a nivel de la fibrosa mitro-aórtica no fueron categóricos. Se realiza tomografía con emisión de positrones (PET)/CT con 18 F-flurodesoxiglucosa (F-FDG) que informó válvula aórtica protésica con tejido hipermetabólico de partes blandas en relación a válvula protésica, de aspecto inflamatorio. Además, en paralelo se solicita TCC que informa lesión nodular de la prótesis aórtica en relación a velo coronario izquierda de 16 x 8 mm, asociado a cambios inflamatorios que rodean al origen de la arteria coronaria izquierda que se extienden a la fibrosa mitro-aórtica con laguna que nace en el tracto de salida inmediatamente subvalvular, y otra laguna vascular adyacente al marco de la prótesis compatible con pseudoaneurisma (Figura 1D y 1E).
Con los hallazgos descritos, se realiza resolución quirúrgica, donde se evidencia absceso anular y velo protésico izquierdo comprometido con endocarditis (figura 1F, 1G y 1H). Luego, se realiza recambio valvular aórtico biológico, con evolución post-operatoria sin complicaciones quirúrgicas y sucesivamente el paciente fue dado de alta tras completar terapia antibiótica con buena evolución clínica.
Discusión


La endocarditis infecciosa (EI) es una infección del endotelio del corazón, que incluye las válvulas cardíacas, el endocardio mural y al endotelio que recubre materiales implantados, como las prótesis y los dispositivos1. Sigue siendo una enfermedad poco común, aunque es difícil saber la incidencia real debido a las diferencias geográficas y metodológicas, existen algunos trabajos que sugieren que la incidencia global de la enfermedad puede estar aumentando en relación al aumento de implantes de prótesis cardíacas y dispositivos2. Aún hoy en día la EI supone un reto diagnóstico que requiere un alto índice de sospecha y la combinación de información clínica, técnicas de microbiología e imágenes cardiacas. Éstas últimas juegan un papel muy importante en el diagnóstico, planificación de tratamiento y seguimiento de la enfermedad. En este mismo sentido, somos enfáticos en que el conocimiento de la extensión del compromiso infeccioso de la EI es fundamental para preparar una adecuada cirugía cardiaca.
La EI en válvula protésica es la forma más grave de EI y constituye hasta un 30% de los casos. El diagnóstico es habitualmente difícil puesto que las manifestaciones suelen ser atípicas y las imágenes ecocardiográficas pueden resultar falsamente negativas en una frecuencia relativamente alta, lo que ha determinado que los criterios habituales resulten insuficientes para sustentar la hipótesis diagnóstica1,3.
La ecocardiografìa transtorácica (ETT) y transesofágica (ETE), son las técnicas más importantes para el diagnóstico de EI, pero también para la evaluación pronóstica y el seguimiento de los pacientes durante el tratamiento. Sus hallazgos pueden en muchos casos establecer la indicación quirúrgica junto con la situación clínica del enfermo. Sin embargo, presenta limitaciones en algunos casos, no solamente en evaluar el compromiso valvular protésico donde su sensibilidad es menor, sino que también en valorar la extensión hacia estructuras adyacentes1.
Paralelamente, el TCC se ha posicionado como una herramienta útil para el diagnóstico de complicaciones perivalvulares (abscesos y pseudoaneurismas) que no se pueden definir con el ecocardiograma debido a ventanas subóptimas y ante la presencia de artefactos debido a la presencia de prótesis o severas calcificaciones1,4,5. Se ha reportado mejor rendimiento diagnostico para absceso que el ETE, cuando se compara con los hallazgos quirúrgicos6. No obstante, en la detección de vegetaciones de pequeño tamaño (<10mm) y en el diagnóstico de perforaciones la sensibilidad de la técnica disminuye6,7. Se ha descrito que el TCC no es superior a la ecocardiografía en el diagnóstico de vegetaciones, perforación de velos y en fugas perivalvulares, pero sería útil cuando la ecocardiografía da resultado indeterminado o hay sospecha de compromiso a nivel de fibrosa mitro-aortica6. Sumando a lo anterior, otras ventajas del TCC es su rápida adquisición, realizable en pacientes inestables hemodinámicamente y proveer información preoperatoria (anatomía coronaria, proximidad de estructuras al esternón, y calcificación aortica)6.
El PET con 18 F-FDG también ha demostrado ser una técnica útil, sobre todo en casos que se categorizan inicialmente como “posible” según los criterios de Duke modificados y para la detección de embolias periféricas1,6. Su rendimiento radica en la evaluación de la presencia de abscesos perivalvulares o vegetaciones paravalvulares, lo que explica su mayor rendimiento en EI en válvula protésica más que en válvula nativa8. Se debe realizar lo más cercanamente de la sospecha diagnostica para disminuir los falsos negativos, ya que una terapia antibiótica empírica apropiada disminuye la inflamación, incluso describiendo que niveles de proteína C reactiva bajo 40 mg/l se asocia a un menor rendimiento de la tecnica8. A su vez, se recomienda realizarlo luego de 3 meses de una cirugía cardiaca para disminuir los falsos positivos, pero se ha visto que tras 1 mes hay rendimiento, sobre en casos de patrón de intensidad intensa y focal8,9. Además, falsos positivos se han descrito más allá de 3 meses, sobre todo con ciertos adhesivos quirúrgicos como BioGlue (Cryolife Inc) y un modelo especifico de bioprótesis mitral Medtronic Mosaic8.
Finalmente, la decisión del tratamiento quirúrgico es probablemente el aspecto más difícil del manejo de los pacientes con endocarditis infecciosa en válvula protésico, y a esto le sigue el momento de realizarlo. Las guías de endocarditis hacen recomendación fuerte (1C) de resolución quirúrgica para las endocarditis infecciosas en válvula protésica precoz antes de 6 meses, y la recomendación del momento quirúrgico entre emergente, urgente y no urgente depende de las manifestaciones de insuficiencia cardiaca, control infeccioso, y riesgo embólico1. En nuestro caso, el principal conflicto fue la cirugía cardiaca reciente y la presencia de monobypass, donde dada la estabilidad clínica se realizó el recambio valvular aproximadamente a 7 días más tarde del diagnóstico categórico, y consideramos que el buen resultado quirúrgico fue consecuencia a la desinflamación tras el manejo antibiótico apropiado y seguimiento especializado.
La imagen cardiaca juega un papel fundamental en el diagnóstico y la evaluación pronóstica de los pacientes con EI, donde la ecocardiografía continúa siendo la modalidad de primera línea. No obstante, en presencia de material protésico tiene algunas limitaciones. Frente a esto, el TCC y PET/CT han nacido como herramientas que permite el diagnóstico de complicaciones para y perivalvulares en pacientes cuyo estudio ecocardiográfico no ha sido concluyente.
1. Bruno Hoen, MD; François Alla, MD; Christine Selton-Suty, MD; et al. Changing Profile of Infective Endocarditis Results of a 1-Year Survey in France. JAMA 2002; 288:75-81
2. Carmen Olmos, Aída Ortega-Candil y Fabián Islas. El papel de las nuevas técnicas de imagen en el diagnóstico de la endocarditis infecciosa. REC CardioClinics. 2019;54(1):4–8
3. Anaïs Grob & Franck Thuny & Chloe Villacampa & Antonin Flavian & Jean Yves Gaubert & Didier Raoult & J. P. Casalta & Gilbert Habib & Guy Moulin & Alexis Jacquier. Cardiac multidetector computed tomography in infective endocarditis: a pictorial essay. Insights Imaging (2014) 5:559–570
4. Gudrun M. Feuchtner, MD, PD, Paul Stolzmann, MD,§ Wolfgang Dichtl, MD, PHD, PD,† Thomas Schertler, MD,§ Johannes Bonatti, MD, FECTS, Hans Scheffel, MD,§ Silvana Mueller, MD,† André Plass, MD, Ludwig Mueller, MD, Thomas Bartel, MD, PD,† Florian Wolf, MD, Hatem Alkadhi, MD, PD. Multislice Computed Tomography In Infective Endocarditis. Comparison With Transophageal Ecocardiography and Intraoperative Findings. J Am Coll Cariol. 2009;53:436-444
5. Kim IC, Chang S, Hong GR, et al. Comparison of cardiac computed tomography with transesophageal echocardiography for identifying vegetation and intracardiac complications in patients with infective endocarditis in the era of 3-dimensional images. Circ Cardiovasc Imaging. 2018;11:e006986.
6. Hutt E, Canosa FJM, Unai S, Jaber WA. Manifestations of Prosthetic Valve Endocarditis: Lessons From Multimodality Imaging and Pathological Correlation. Circ Cardiovasc Imaging. 2024;17(4):e016435.
7. Hryniewiecki T, Zatorska K, Abramczuk E, Zakrzewski D, Szymański P, Kuśmierczyk M, et al. The usefulness of cardiac CT in the diagnosis of perivalvular complications in patients with infective endocarditis. Eur Radiol. 2019; 29 (8): 4368-76.
8. Boczar KE, Lau L, Hejji N, Wiefels C. Infective Endocarditis: The role of PET imaging in diagnosis and management. J Med Imaging Radiat Sci. 2024;55(2S):S17-S25.
9. Ten Hove D, Slart RHJA, Sinha B, Glaudemans AWJM, Budde RPJ. 18F-FDG PET/CT in Infective Endocarditis: Indications and Approaches for Standardization. Curr Cardiol Rep. 2021;23(9):130.
Discusion: No hay comentarios
