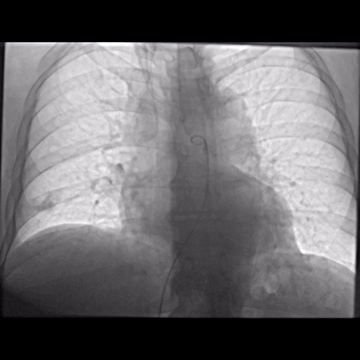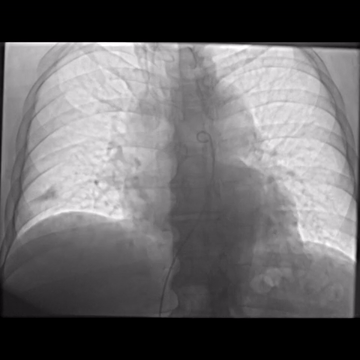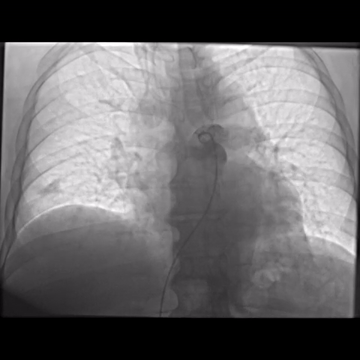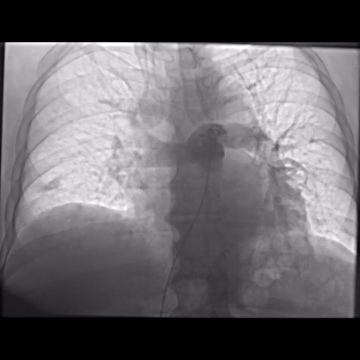
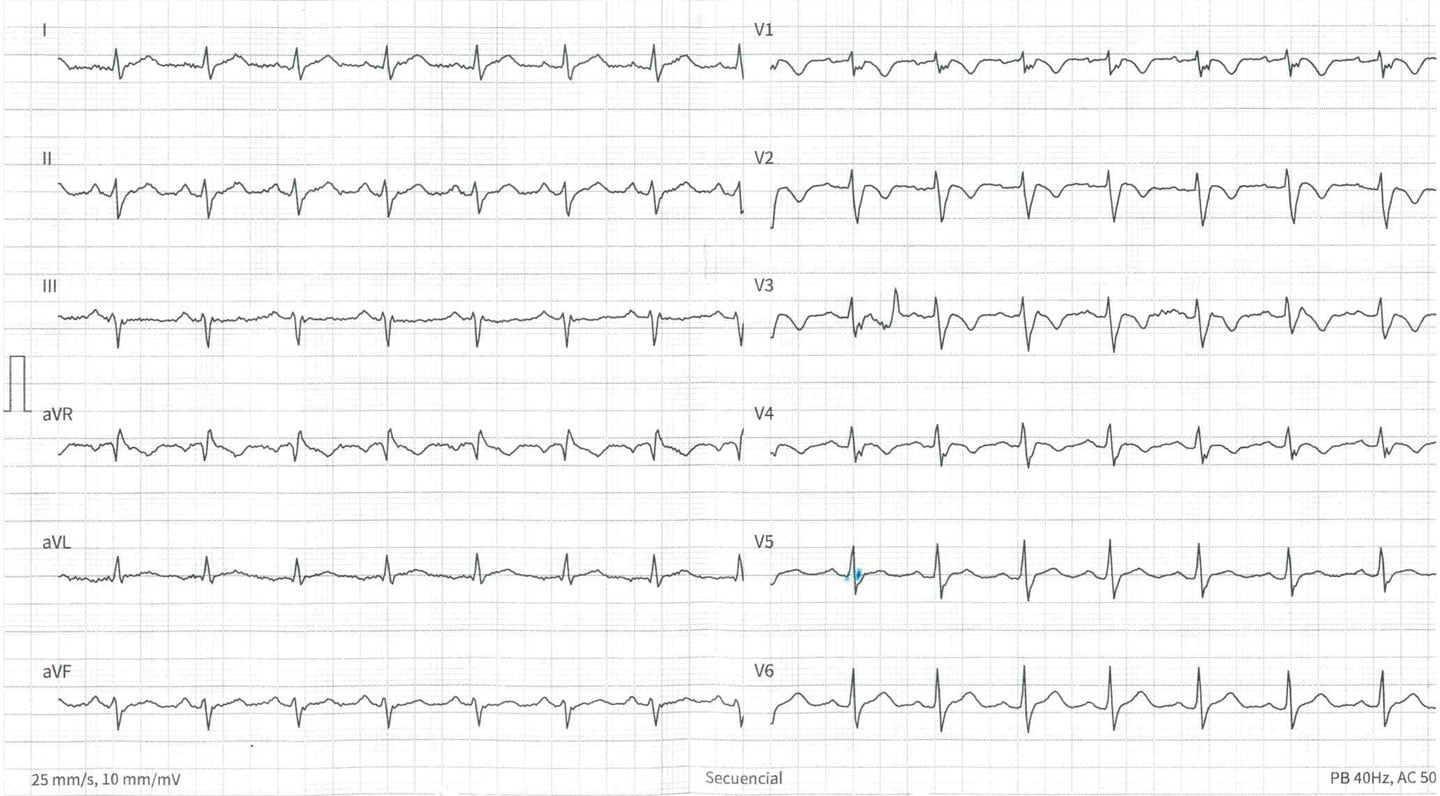
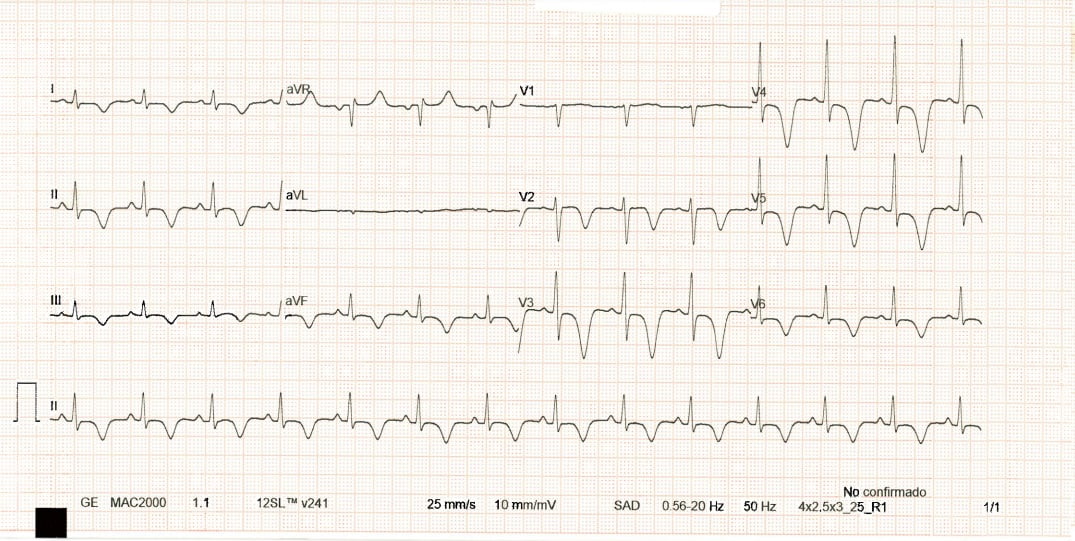
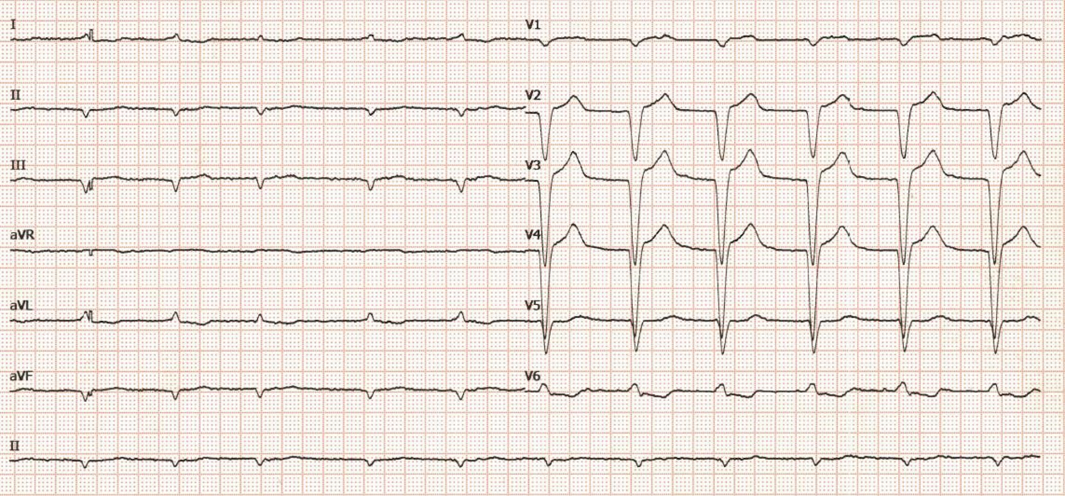
El tromboembolismo pulmonar (TEP) es la tercera causa más común de muertes cardiovasculares en todo el mundo, después del infarto de miocardio y las enfermedades cerebrovasculares, con una incidencia anual de 39-115 por cada 100 000 habitantes y es una de las principales causas de mortalidad cardiovascular en Europa y la USA, que representa alrededor de 150.000-250.000 hospitalizaciones, y alrededor de 60.000-100.000 muertes al año 1 2. La tasa de mortalidad a 30 días de pacientes con TEP que desarrollan shock cardiogénico oscila entre el 16 y el 25%, y en los pacientes que sufrieron paro cardíaco, entre el 52 y el 65% 3.
Las terapias avanzadas, como la fibrinólisis sistémica y la embolectomía, tienen el potencial de reducir la sobrecarga de presión del ventrículo derecho (VD) en TEP con riesgo alto e intermedio alto, y una menor mortalidad al revertir la obstrucción arterial pulmonar y la falla del VD. En el estudio más grande de fibrinólisis sistémica de dosis completa, la tenectoplasma redujo el riesgo de muerte o colapso autovascular en un 56% en 1.006 pacientes con TEP submasivo 4. Sin embargo, este beneficio se vio compensado por un riesgo casi 5 veces mayor de sangrado mayor y un riesgo 10 veces mayor de accidente cerebrovascular hemorrágico. Los metaanálisis de los ensayos de fibrinólisis sistémica para la TEP aguda han demostrado hallazgos similares. 5
Las intervenciones dirigidas al uso del catéter se están convirtiendo en métodos valiosos, siendo prometedores para el tratamiento del TEP. La trombólisis asistida por ultrasonido (TAUS) es una forma de terapia fibrinolítica local mejorada por la energía acústica, que facilita la penetración del fármaco ítico en los trombos, al mejorar la descomposición mecánica del trombo, así aumentando el área de superficie por lo tanto los sitios receptores de plasminógeno están más activos y en contacto con el agente trombolítico.Esta intervención permite el uso de dosis líticas más bajas en comparación con la trombólisis sistémico 1 6. Esta terapia localizada está recomendada por las directrices de ESC para pacientes con EP de alto riesgo y contraindicaciones para la trombólisis sistémica o EP intermedio de alto riesgo y deterioro hemodiómico 7
La TAUS pudo mostrar una mejora en la perfusión pulmonar y la función del VD y una disminución en la presión de la arteria pulmonar sistólica (PAPs) y la relación entre el ventrículo derecho y el ventrículo izquierdo (VD/VI) (2). Estudios han demostrado que un promedio de 20-24 mg de alteplasa administrados a través de TAUS durante 12-24 horas revirtió de manera eficiente la dilatación del VD y mejoró la hemodinámica pulmonar en pacientes con TEP de riesgo intermedio-alto 6.
En el estudio ULTIMA, se administró rtPA por catéter a una velocidad de 1 mg/h durante las primeras 5 horas y después de eso 0,5 mg/h durante las 10 horas siguientes, lo que resultó en una duración del tratamiento de 15 horas, demostrando que la TAUS estandarizado fue superior a la anticoagulación con heparina sola para revertir la dilatación del VD a las 24 horas, sin un aumento de las complicaciones hemorrágicas 8.
En el estudio SEATTLE-2, para los pacientes con un catéter, se administró rtPA a una velocidad de 1 mg/h durante 24 horas. Los pacientes con dos dispositivos recibieron 1 mg/h durante 12 horas por catéter, observando una disminución del 25 % en la relación de diámetro VD/VI, una disminución del 30 % en la PAPs al final del procedimiento y una disminución del 30 % en la obstrucción angiográfica de la arteria pulmonar en 48 horas y no hubo episodios de hemorragia intracraneal. 9
El estudio OPTALYSE comparó 4 regímenes, utilizando de 4 a 12 mg de rtPA por catéter en un plazo de 2 a 6 horas en 101 pacientes con EP de riesgo intermedio, en el 86 % de los casos se necesitaron 2 catéteres. Solo en el primer brazo (4 mg de rtPA por catéter durante 2 horas), no se produjo un sangrado importante. La tasa de sangrado mayor en todos los grupos juntos fue 4%. Demostraron que con dosis más bajas e infusiones más cortas de terapia trombolítica en el TEP agudo de riesgo intermedio se asocia con una mejora en la relación del diámetro VD/VI, así como con una reducción de la carga de coágulos a las 48 horas 10.
Los beneficios a largo plazo de la TAUS aún no se han establecido. Si bien hay un beneficio evidente a corto plazo y una mejora clínica significativa, hay una falta de estudios prospectivos que sigan a estos pacientes a largo plazo después de recibir tratamiento 1. Sin embargo, Klein, et al, quiene evaluaron el efecto a mediano plazo, en 51 paciente con TEP riesgo intermedio alto o riego alto, observando la reducción del estrés del corazón derecho no solo durante las primeras 24 horas, sino también durante el seguimiento a medio plazo a los 6 meses 2.
Por lo tanto la TASU parece ser una opción viable y segura, obteniendo una mejora clínica significativcon, con menor riesgo de complicaciones, que se debe utilizar de forma individualizada en casos de pacientes con TEP riesgo intermedio alto o riego alto con contraindicaciones para el tratamiento trombolítico o con alto riesgo de hemorragia.
Bibliografía
1 Khan K , Yamamura D, Vargas C, Alexander T , Surani S. The Role of EkoSonic Endovascular System or EKOS® in Pulmonary Embolism. Cureus 2019. 11(12): e6380. DOI 10.7759/cureus.6380
2 Klein F, Mo ̈bius S , Ba ̈z L, Pfeifer R, Fritzenwanger M, Heymel S, et al. EKOSTM Jena Experience: Safety, Feasibility, and Midterm Outcomes of Percutaneous Ultrasound-Assisted Catheter- Directed Thrombolysis in Patients with Intermediate-High-Risk or High-Risk Pulmonary Embolism. Canadian Respiratory Journal. Volume 2022, Article ID 7135958, 9. https://doi.org/10.1155/2022/7135958
3 Escutia H, Alcántara M, Fuentes P, Orozco G, Rentería A, Rivas R, et al. Fibrinólisis de baja dosis facilitada por ultrasonido dirigida por catéter en tromboembolismo pulmonar agudo. Reporte de un caso. Arch Cardiol Mex. 2019;8
4 Meyer G, Vicaut E, Danays T, et al. Fibrinolysis for patients with intermediate-risk pulmonary embolism. N Engl J Med 2014;370:1402–11.
5 Marti C, John G, Konstantinides S, et al. Sys- temic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. Eur Heart J 2015;36:605–14.
6 Stępniewskia J, Kopeća G, Musiałeka P, Magońa W, Jonasa K, Waligóraa M, et al. Hemodynamic Effects of Ultrasound-Assisted, Catheter-Directed, Very Low-Dose, Short- Time Duration Thrombolysis in Acute Intermediate–High Risk Pulmonary Embolism (From the EKOS-PL Study). Am J Cardiol.. 2021 Feb 15;141:133-139
7 Konstantinides S, Meyer G, Becattini C, et al. “2019 ESC guidelines for the diagnosis and management of acute pul- monary embolism developed in collaboration with the Eu- ropean Respiratory Society (ERS),” European Heart Journal, vol. 41, no. 4, pp. 543–603, 2020.
8 Kucher N, Boekstegers P, Mu ̈ller O, et al., “Randomized, controlled trial of ultrasound-assisted catheter-directed thrombolysis for acute intermediate-risk pulmonary embo- lism,” Circulation, vol. 129, no. 4, pp. 479–486, 2014.
9 Piazza G, Hohlfelder B, Jaff M, Ouriel K, Engelhardt T, Sterling K, et al. A Prospective, Single-Arm, Multicenter Trial of Ultrasound-Facilitated, Catheter-Directed, Low-Dose Fibrinolysis for Acute Massive and Submassive Pulmonary Embolism. The SEATTLE II Study. JACC: CARDIOVASCULAR INTERVENTIONS VOL. 8, NO. 10, 2015 AUGUST 24, 2015:1382–92
10 V. F. Tapson, K. Sterling, N. Jones et al., “A randomized trial of the optimum duration of acoustic pulse thrombolysis procedure in acute intermediate-risk pulmonary embolism: the OPTALYSE PE trial,” JACC: Cardiovascular Interventions, vol. 11, no. 14, pp. 1401–1410, 2018