Escrito Por:
Dra. María Virginia Araya Álvarez 1 2 3
E.U Karen Ugarte Villalobos 1 3
1 Instituto cardiológico Iquique
2 Delegada SOCHICAR Comité Mujeres SIAC-SSC
3 Miembro Dpto. Prevención SOCHICAR
En Chile existen escasos estudios que abordan el problema de la co-morbilidad entre el trastorno de pánico (TP) y el prolapso de la válvula mitral (PVM). Los pocos trabajos publicados en el país en los últimos años orientan hacia una asociación significativa entre ambas patologías, hecho que es consistente con la mayoría de los estudios internacionales. En particular, en la provincia de Iquique tanto los trastornos cardiovasculares – especialmente el infarto agudo del miocardio – como los trastornos psiquiátricos tienen una muy alta prevalencia respecto a las tasas nacionales; este hecho nos ha puesto en relación en nuestra práctica clínica con una importante población de sujetos que padecen de ambas patologías, lo que ha motivado nuestro interés por conocer las características epidemiológicas de esta asociación en el norte del país.
La prevalencia de TP en diversos estudios internacionales oscila entre un 0.3% y un 3 % A. Cía reporta una prevalencia entre 1.5% y 3.0% en la población general, 7% en la consulta de atención primaria y 22% en la atención de urgencia. Un estudio croata reciente arroja una prevalencia de TP puro en la población general de un 2%. Investigaciones norteamericanas hablan de una prevalencia de 3%. Los estudios coinciden en que por razón no clara frecuencia de este trastorno es 2 veces mayor en mujeres, y en que es constante a nivel mundial, lo que debilitaría las hipótesis que asocian al TP con factores culturales o étnicos.
La co-morbilidad entre TP y PVM también ofrece algunas dificultades en relación a su prevalencia, tanto en los estudios internacionales como en los pocos trabajos realizados en este campo a nivel nacional. Una parte de las investigaciones ha analizado la frecuencia de PVM en una muestra de pacientes con diagnóstico clínico de TP y otra ha actuado en un sentido inverso: a partir de una muestra de personas afectadas por PVM ha intentado precisar aquellos casos en que se pesquisa un TP. En ambas líneas de investigación subyace un interés por contribuir al estudio de las posibles relaciones causales entre ambos trastornos. En relación a la incidencia de PVM en pacientes portadores de TP, el estudio japonés ya citado informa una prevalencia de 32.0% de PVM en una muestra de 121 pacientes con TP. En esta misma dirección, un interesante estudio sobre una muestra de TP dentro del primer año de evolución de dicho trastorno psiquiátrico y una segunda muestra de TP con más de 10 años, informó de una prevalencia de PVM en el primer caso de 25% y en el segundo de 29% (sin significancia estadística) A nivel nacional, un trabajo realizado sobre una pequeña muestra de 23 casos de TP, pesquisó PVM en el 39.13% de los casos.
Respecto de las bases neurobiológicas del TP, se postula que existen numerosas sustancias que tienen capacidad para provocar crisis de pánico: lactato de sodio, yohimbina, dióxido de carbono, colecistoquinina, norepinefrina. Sin embargo, aún no se ha logrado establecer la existencia de patrones comunes a todos ellos que iluminen respecto de los mecanismos patofisiológicos que están en la base de la producción de la crisis de pánico. Finalmente, recientes investigaciones con neuroimagen sugieren que existiría una hipersensibilidad intrínseca de ciertas estructuras cerebrales, tales como la amígdala y su proyección en el tronco cerebral, el hipocampo y la corteza prefrontal medial, todas ellas ligadas a los circuitos del miedo en el hombre y, en el caso de sujetos que padecen trastornos de ansiedad, podrían estar anormalmente sensibles.
Diversas hipótesis se han ensayado para explicar causalmente el PVM. Una parte importante de los casos corresponde a PVM de origen primario y otra se adscribe como acompañante de diversas patologías: enfermedades del tejido conectivo (síndrome de Marfán, síndrome de Ehlers-Danlos, osteogénesis imperfecta, periateritis nodosa, distrofia miotónica), malformaciones cardíacas (anomalía de Ebstein, comunicación interauricular del tipo ostium secundum, síndrome de Holt-Oram), cardiomiopatía hipertrófica, etc.
Algunos autores postulan una variedad de anomalías neuroendocrinas como fundamento fisiopatológico del PVM, tales como: altos niveles de adrenalina y noradrenalina; alteración del eje renina-angiotensina-aldosterona; altos niveles plasmáticos de factor natriurético auricular.
Otros estudios etiológicos se han focalizado en el rol del magnesio plasmático en la producción de PVM, postulándose la hipomagnesemia como causa de un aumento de la secreción de catecolaminas; Lichodziejewska y col. analizaron una muestra de 141 sujetos con manifestaciones severas de los síntomas clínicos de PVM, los compararon con un grupo control de 40 sujetos sanos y encontraron que la prevalencia de hipomagnesemia fue de 60% en los casos con PVM y 5% en el grupo control (p<0.0001); así mismo, pesquisaron en el primer grupo altos niveles de excreción de catecolaminas (63% vs 17%). Finalmente, encontraron que después de 5 semanas de tratamiento supletorio con magnesio se obtuvo una disminución de la sintomatología en un 50%.El estudio de Hamada ya mencionado da cuenta del impacto del sistema neurovegetativo en pacientes que presentan PVM en asociación con TP; el intervalo R-R en el electrocardiograma disminuyó significativamente en relación a un grupo control sano y aún más en aquellos sujetos que presentaban trastorno depresivo asociado al TP.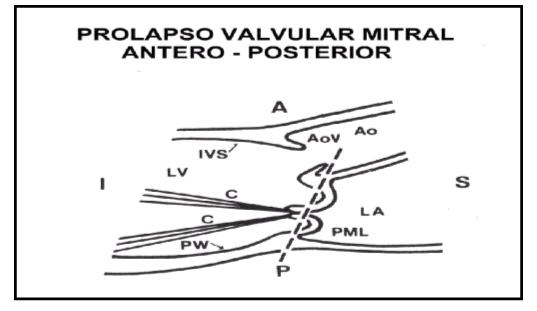
A = Anterior
C= Cuerdas tendíneas
P= Posterior
PW= Pared posterior
I= Inferior
AoV= Válvula aórtica
S= Superior
AO= Aorta
IVS= Septum interventricular
LA= Aurícula izquierda
LV= Ventrículo izquierdo
PML=Prolapso velos Mitrálicos
La mayoría de las investigaciones realizadas en los últimos años han ido ratificando el notable aumento de la presencia de PVM en personas que padecen TP en relación con la población general. Precisamente a raíz de esta constatación es que se ha hecho cada vez más interesante el estudio de las relaciones causales que probablemente pueden dar cuenta de esta asociación co-mórbida y se ha aumentado el interés de los clínicos por investigar la eventual presencia de una de estas dos patologías cuando pre-existe la otra; este problema se torna muchas veces perentorio a la luz de la frecuente presencia de síntomas comunes a ambas, como la precordalgia, las arritmias, las palpitaciones, el ortostatismo y los mareos, manifestaciones que no permiten diferenciar semiológicamente ambos trastornos.
La distribución etaria de los casos de TP en el grupo en estudio se concentra en el adulto joven, especialmente en la edad de máxima producción (30 – 49 años) lo que resulta también coherente con lo comunicado en la literatura respecto no sólo del TP sino de todas las patologías que se ubican en el espectro de los trastornos de angustia. El subgrupo de TP asociado a PVM se distribuye de manera similar, centrándose en el adulto joven. Lo importante desde el punto de vista tanto de la intervención terapéutica como de las estrategias de prevención de estas patologías es que quienes se afectan preferentemente con ellas son las personas que se encuentran sociolaboralmente activas.
Existen hoy diversos intentos explicativos de la convergencia de estas dos patologías, casi todos ellos con asiento en causales neuroendocrinas, como ya hemos descrito en la introducción de este trabajo. En relación a la fisiopatología del PVM y la producción tanto de síntomas no específicos como neuropsiquiátricos no están del todo claro los mecanismos específicos subyacentes, pero se piensa que en esta asociación existirían causales multifactoriales. Una de estas teorías, tal vez la de mayor relevancia en la actualidad, se relaciona con el péptido natriurético auricular, sustancia producida en forma endógena por la sobre distensión auricular desencadenando vasodilatación y aumento de la excreción renal de sodio; estos cambios contrarrestan los efectos retenedores de sal y agua del sistema renina-angiotensina-aldosterona y de las catecolaminas.
Este mecanismo favorecería el desbalance del sistema simpático-parasimpático al producir disminución de la volemia y vasodilatación con un correlato clínico de hipotensión, taquicardia, palpitaciones, mareos, debilitamiento físico, etc. Los factores desencadenantes del aumento de la secreción del factor natriurético auricular podrían ser: regurgitación de la válvula mitral; aumento de la frecuencia cardíaca y arritmias secundarios al PVM; desbalance en el sistema nervioso central neuroendocrino; aumento de la secreción de catecolaminas de diverso origen.
En lo relativo a las teorías genéticas se conocen algunos estudios recientes que asocian estos trastornos a entidades sindromáticas plurisistémicas de diverso tipo. Un estudio sobre 23 pacientes con TP mostró evidencias de vinculación con locus del cromosoma 7, que contiene el gen de la elastina, eminente componente de la válvula mitral; esto sería relevante respecto de la asociación entre la laxitud de la válvula y una disposición heredo-constitucional del paciente para sufrir ansiedad. Por otra parte, se describe un posible “síndrome del cromosoma 13”, que incluye TP, problemas renales o vesicales, cefalea intensa, problemas tiroideos (usualmente hipotiroidismo) y/o PVM; este síndrome fue identificado en el curso de una investigación de ligazón genética de TP en miembros individuales de la familia, lo que hace suponer la existencia de un subgrupo de pánico familiar que presenta estas condiciones clínicas.
En esta misma línea, investigadores españoles describen una alteración genética que predispondría a padecer crisis de pánico, agorafobia y otras formas de ansiedad en relación estrecha con laxitud articular, trastorno este último que se caracteriza por una extrema flexibilidad de las articulaciones.
Los autores han comunicado una asociación de TP con esta patología articular en más del 70% de los casos; la perturbación genética que está en la base de esta enfermedad es una duplicación del cromosoma 15, DUP25, alteración que se encontraría en el 95% de los pacientes con TP y sólo en el 7% de la población general. Por otra parte, numerosos estudios sobre gemelos han establecido que la frecuencia de TP es mayor entre gemelos monocigotos que dizigotos, lo que refuerza notablemente la sospecha que el desarrollo del TP pudiera estar parcialmente bajo control genético; hay consenso, sin embargo, de que resulta poco probable que esté involucrado un gen único. Algunos autores han señalado que a pesar de estas evidencias ligadas a los fundamentos genéticos del TP, no es posible adscribir en forma exclusiva la causalidad a lo genético; en efecto, en el caso de los gemelos monocigóticos la frecuencia de concordancia clínica del TP no supera el 50%, lo que se explica por la existencia de factores ambientales, como las separaciones traumáticas en la infancia, los duelos, la angustia de separación, los traumas escolares, etc.
En suma, existen hoy interesantes observaciones científicas que avalan la existencia de un sustrato interconector de tipo neuroendocrinológico y genético para ambas patologías, lo que otorga gran importancia a la necesidad de investigar las bases biológicas que explican esta co-morbilidad. Este desafío tiene implicancias en el mejor conocimiento del comportamiento clínico de esta asociación mórbida. En el caso de las personas que presentan sólo PVM el curso evolutivo implica una gradiente sintomática que va desde los casos en que no hay sintomatología cardiaca hasta aquellos con intensos malestares. Según H. Boudoulas et als. , esta gradiente considera:
1. Un mayoritario grupo de pacientes asintomáticos.
2. Aquellos pacientes cuyo defecto valvular no se asocia a regurgitación valvular y en los cuales predomina la sintomatología de tipo autonómico: taquicardia, palpitaciones, sudoración, mareos, fatigabilidad, síntomas derivados del ortostatismo, etc.
Un grupo menor de pacientes en los cuales la evolución clínica se ha complicado con la aparición de la regurgitación valvular, lo que agrega otra sintomatología, aquella proveniente de los cambios hemodinámicas precipitados por este evento patológico: dolor precordial intermitente, disnea, arritmias severas, deterioro de la función cardiovascular, etc.
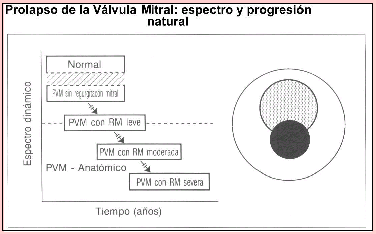
Área 1: PMV asintomático
Área 2: PVM con síntomas autonómicos
Área 3: PMV con síntomas mixtos autonómicos y de disfunción valvular leve
Área 4: PMV con predominio de síntomas de disfunción valvular moderada y severa


